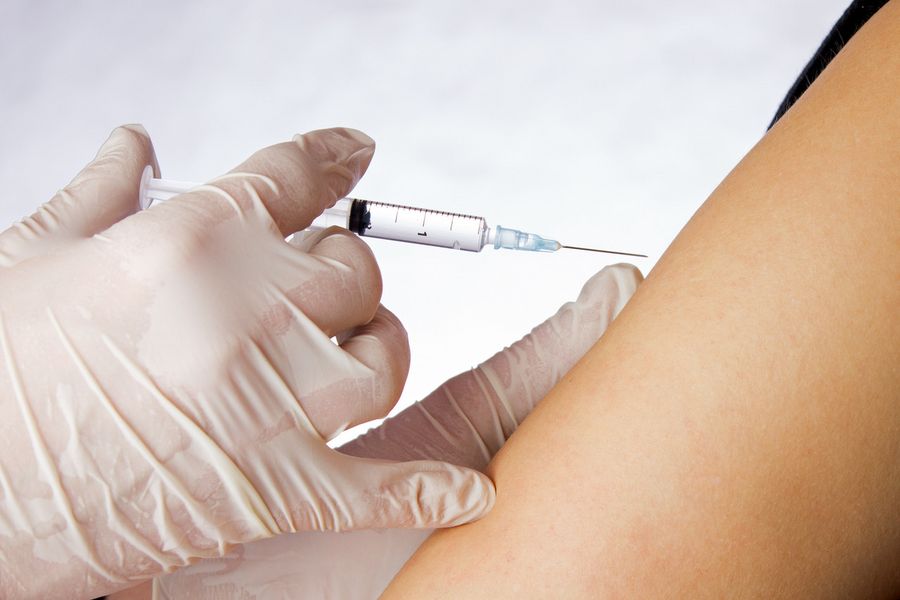
Seit Beginn der weltweiten Corona-Pandemie steht das Thema „Impfung“ bei unseren Patientinnen und Patienten mit chronisch-entzündlichen Hauterkrankungen wie Neurodermitis (Atopischer Dermatitis) oder Schuppenflechte (Psoriasis) wieder sehr im Mittelpunkt, vor allem, wenn die Betroffenen unter einer immunmodulierenden oder immunsupprimierenden Therapie stehen. Dies bezieht sich ganz allgemein auf Impfungen gegen Influenza (Grippe-Schutzimpfung) oder Pneumokokken und aktuell natürlich auf eine Impfung gegen SARS-CoV-2, den Auslöser der COVID-19-Erkrankung.
Für die betroffenen Patientinnen und Patienten, aber auch die behandelnden hautärztlichen Kolleginnen und Kollegen, ist nachfolgende Positionierung und Empfehlung gedacht; sie soll Ängste und Sorgen nehmen und drängende Fragen beantworten sowie die allgemeine Impfbereitschaft fördern:
- Unverändert gilt die Empfehlung, dass Patienten mit chronisch-entzündlichen Hauterkrankungen, ohne und mit immunmodulierender oder immunsupprimierender Therapie, einen ausreichenden Impfschutz gemäß den Empfehlungen der Ständigen Impfkommission (STIKO) des Robert-Koch-Instituts (RKI) haben sollten. Dieser Impfschutz sollte nach Möglichkeit vor Therapiebeginn komplettiert sein, kann mit Totimpfstoffen aber auch unter Therapie vervollständigt oder eingeleitet werden.
- Dies gilt im Besonderen für die Pneumokokken-Impfung, sowie die jährliche Influenzaschutzimpfung, denn die Erkrankungen können sehr schwer verlaufen und häufig kommt es zu sogenannten Sekundärinfektionen, also weiteren bakteriellen Atemwegsinfektionen, die sich auf die Influenza obendrauf setzen können. Da sich Influenzaviren ständig verändern, gibt es jedes Jahr einen neuen (Vierfach)-Impfstoff. Neben dem Schutz vor der eigentlichen Infektion gibt es auch Hinweise darauf, dass Personen, die gegen Influenza geimpft wurden, ein geringeres Risiko aufweisen, sich mit SARS-CoV-2 zu infizieren als nicht gegen Influenza-Geimpfte.
- Im Rahmen von umfangreichen Zulassungsstudien aller COVID-19-Impfstoff-Kandidaten wurden zwar bereits mehrere zehntausend Personen kontrolliert geimpft – deutlich mehr, als für jeden Impfstoff bislang erforderlich gewesen war –, aber natürlich können noch keine Daten zur Sicherheit und Wirksamkeit bei Personen mit chronisch-entzündlichen Hauterkrankungen beziehungsweise Patienten unter immunmodulierender/immunsuppressiver Therapie vorliegen.
- Aus grundsätzlichen Erwägungen sollte die Immunsuppression für eine ausreichende Impfantwort (Bildung schützender Antikörper gegen die Krankheitserreger) so gering wie möglich sein. Immunsuppressive Wirkstoffe spielen bei Patienten mit chronisch entzündlichen Hauterkrankungen eine untergeordnete Rolle; immunmodulierende Wirkstoffe haben nach derzeitigem Kenntnisstand keine Beeinträchtigung der Impfantwort zur Folge, sodass zum gegenwärtigen Zeitpunkt nicht empfohlen werden kann, zum Beispiel eine bestehende immunmodulierende/immunsuppressive Therapie bei Schuppenflechte wegen einer – bezüglich COVID-19 derzeit auch noch nicht allgemein verfügbaren – Impfung zu verändern.
- Ganz allgemein sollte beachtet werden: unter einer laufenden Therapie gilt als Empfehlung, die Impfung in der Mitte eines Behandlungsintervalls zu verabreichen und die Therapie frühestens nach zwei Wochen fortzusetzen, da sich die Impfantwort gegen SARS-CoV-2 nach 7-10 Tagen ausbildet. Spezielle Empfehlungen für Therapien, die wöchentlich oder gar (mehrfach) täglich appliziert werden müssen, existieren nicht. Meine persönliche Empfehlung lautet hier, je nach Krankheitsaktivität die Zeiträume nach Impfung auch vor der Impfung gelten zu lassen, also für zwei Wochen vor der Impfung die Einnahme zu pausieren.
- Unterschiede der verschiedenen Impfstoffe: die aktuell zugelassenen Impfungen von Biontech-Pfizer und Moderna werden zwei Mal im Abstand von drei Wochen verimpft. Eine Wiederaufnahme der Psoriasistherapie innerhalb dieser drei Wochen halte ich für nicht ratsam. Der Impfstoff von Astra-Zeneca wird ebenfalls zwei Mal verimpft, hier kann der Abstand aber vier bis zwölf Wochen betragen; hier kann je nach tatsächlichem Impfintervall die Therapie zwischen beiden Impfungen wieder aufgenommen werden.
- Praxis-Beispiele: Biologika-Patienten mit einem vierwöchigen/monatlichen Applikationsintervall können ihre erste Corona-Impfung zwei Wochen nach der letzten Biologikum-Gabe erhalten, drei beziehungsweise vier Wochen später erfolgt dann die zweite Impfung und weitere zwei Wochen später dann die Fortsetzung der Therapie. Für Biologika mit einem acht beziehungsweise zwölf Wochen-Intervall kann vier beziehungsweise sechs Wochen nach der letzten Therapie-Injektion mit der Corona-Impfung begonnen werden, weitere drei Wochen später würde dann die zweite Schutzimpfung gegeben. Am Injektionsintervall des Biologikums (acht beziehungsweise zwölf Wochen) ändert sich dadurch kaum etwas (1 Woche Verschiebung Guselkumab) oder nichts. Bezüglich des Astra-Zeneca-Impfstoffes siehe Punkt 6.
- In Anbetracht der zum Teil langanhaltenden Wirksamkeit der verschiedenen Substanzen ist nur selten mit einer Verschlechterung der Grunderkrankung zu rechnen.
Dr. Ralph von Kiedrowski,
Mitglied des Vorstands / Referent für Presse- und Öffentlichkeitsarbeit